余先生在数月前因急性心肌梗死入院,住院期间进行了经皮冠脉支架置入术(PCI),在前降支置入了一枚支架。出院后一直服用阿司匹林和替格瑞洛这两个药进行联合抗血小板治疗,近日,因高血压控制不佳来药学门诊就诊,在与药师交流过程中,他提到对自己的氯吡格雷基因检测报告单有一点疑惑:自己并未服用氯吡格雷,为何要做氯吡格雷基因检测呢?药师对为何要做氯吡格雷基因检测,以及医生为何未给余先生选用氯吡格雷进行了详细解答。
氯吡格雷即硫酸氢氯吡格雷,属于硫代吡啶家族,是一种抗血小板聚集药物。氯吡格雷是前体药物,其活性代谢产物是一种二磷酸腺苷(ADP)受体阻断剂,与血小板膜表面ADP受体不可逆结合,使纤维蛋白原无法与糖蛋白受体 GP Ⅱb/Ⅲa 结合,抑制血小板聚集,常用于治疗和预防血小板聚集导致的心脑血管栓塞性事件。氯吡格雷是目前使用最广泛的抗血小板药物之一,临床上该药物可降低相关疾病复发率,尤其对于急性冠脉综合征和PCI术后,该药物联合阿司匹林已经成为临床治疗的标准方案。目前为止,我国大约有600万例急性心肌梗死、不稳定型心绞痛和约300多万例脑卒中患者因服用氯吡格雷而获益。

据研究报道,临床有超过 30% 的患者发生氯吡格雷抵抗事件,即使服用氯吡格雷,仍有患者发生支架内血栓形成、再发心肌梗死、心源性死亡、脑中风等心血管不良事件,药物反应个体差异较大。产生个体差异的原因除了患者的依从性、冠心病危险因素 (肥胖、糖尿病、吸烟) 和药物之间的相互作用等因素外, 基因多态性起着重要作用, 特别是直接参与氯吡格雷处置、代谢、转运的基因多态性。
氯吡格雷是一个前体药物,其本身没有活性和作用,需要经过肝脏的酶代谢,才成为活性产物,发挥作用。氯吡格雷在小肠吸收进入循环系统之后,大约85%的药物会被酯酶水解为无活性的羧酸衍生物;15%的药物通过肝脏中的细胞色素酶代谢成活性产物而发挥抗血小板聚集作用,这个过程通过两个连续的氧化步骤完成,第1步:氯吡格雷氧化为 2-氧-氯吡格雷;第2步:后者进一步代谢生成活性硫醇代谢物。细胞色素 P450 酶体系中 CYP1A2、CYP2B6、CYP2C19、CYP2C9、CYP3A4 等多种酶均参与氯吡格雷的活化,CYP2C19 作为参与两个步骤的关键酶对氯吡格雷的活化至关重要。
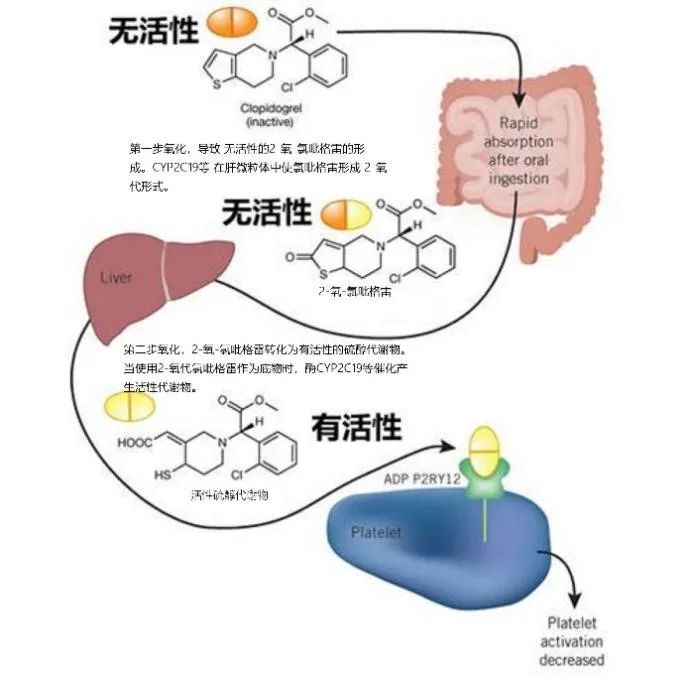
CYP2C19作为关键酶对氯吡格雷的活化起着至关重要的作用,氯吡格雷的抗血小板作用和活性代谢产物的药代动力学随着 CYP2C19 基因型的不同而有差异,因此不是所有的患者服用氯吡格雷后都能获得充分的血小板抑制作用。2010 年 3 月,美国食品药品监督管理局(FDA)宣布氯吡格雷抵抗的「黑框警告」,提醒应用氯吡格雷后出现心血管不良事件与 CYP2C19 功能缺失的等位基因有关,CYP2C19 功能缺失等位基因可减少活性代谢物浓度, 降低血小板功能抑制程度,增加心源性死亡、非致命心肌梗死、支架内血栓或脑中风等心血管不良事件的风险。
CYP2C19基因突变位点有很多。目前,在已发现的CYP2C19 25个突变等位基因中,至少有10个造成了酶活性的改变。遗传药理学和药物基因组学数据库中显示氯吡格雷临床注释证据等级较高的基因位点有CYP2C19*1、*2、*3、*4、*5、*6、*7、*8、*10、*17等,其中*1、*2、*3 和*17 在中国人群中所占的比例比较稳定并且较高。CYP2C19 基因野生型为*1/*1 型,中国人群中较常见的等位基因型为*2 (rs4244285 G>A)、*3 (rs4986893 G>A)和 *17 (rs12248560 C>T)。其中*17可引起 CYP2C19 基因编码的酶活性增强,使得氯吡格雷代谢速度加快,氯吡格雷活性物质的血药浓度升高,抑制血小板聚集作用增强,易发生出血风险;CYP2C19*2和CYP2C19*3导致的CYP2C19酶失活,会使编码蛋白降低甚至丧失活化氯吡格雷的能力,使得氯吡格雷代谢速度减慢,氯吡格雷活性产物减少,抑制血小板聚集作用减弱,即产生氯吡格雷抵抗现象,从而引起较高的支架血栓等心血管事件发生风险。中国人群中*2、*3、*17等位基因频率分别为32.4%和5.8%、0.4%。
因此通过检测*2,*3,*17位点,可以判断该患者是否存在代谢酶的相关异常及氯吡格雷疗效。
通过相关基因检测,得到患者体内的CYP2C19基因的基因型,可判断患者代谢速率类型,根据基因多态性将 CYP2C19 代谢表型分为:超快代谢型(UM)、快代谢型(EM)、中间代谢型(IM) 和慢代谢型(PM)。 医生需根据患者CYP2C19的代谢表型,同时评估患者的出血/血栓风险、疾病状态、器官功能等,给予酌情增减剂量或者换用其他抗血小板药物的建议。
_20240227035859A011.png)
_20240227075250A012.jpeg)
阿司匹林是临床常用的抗血小板药物,至今已经有一百多年历史,最初用于抗炎、解热和镇痛,在上世纪70年代其抗血小板作用被发现后,阿司匹林就主要应用于心血管病的抗栓治疗。
那么,是不是所有人都适合服用阿司匹林呢?
阿司匹林经肠道吸收后很快在体内被水解为水杨酸等物质,与血小板的环氧合酶(COX)活性部分丝氨酸残基发生不可逆的乙酰化反应,使酶失活,抑制花生四烯酸(AA)的代谢,从而抑制血栓素A2(TXA2)的生成,TXA2能够诱导血小板发生聚集反应,而血栓素生成受到抑制则可以很好地起到抗凝作用。
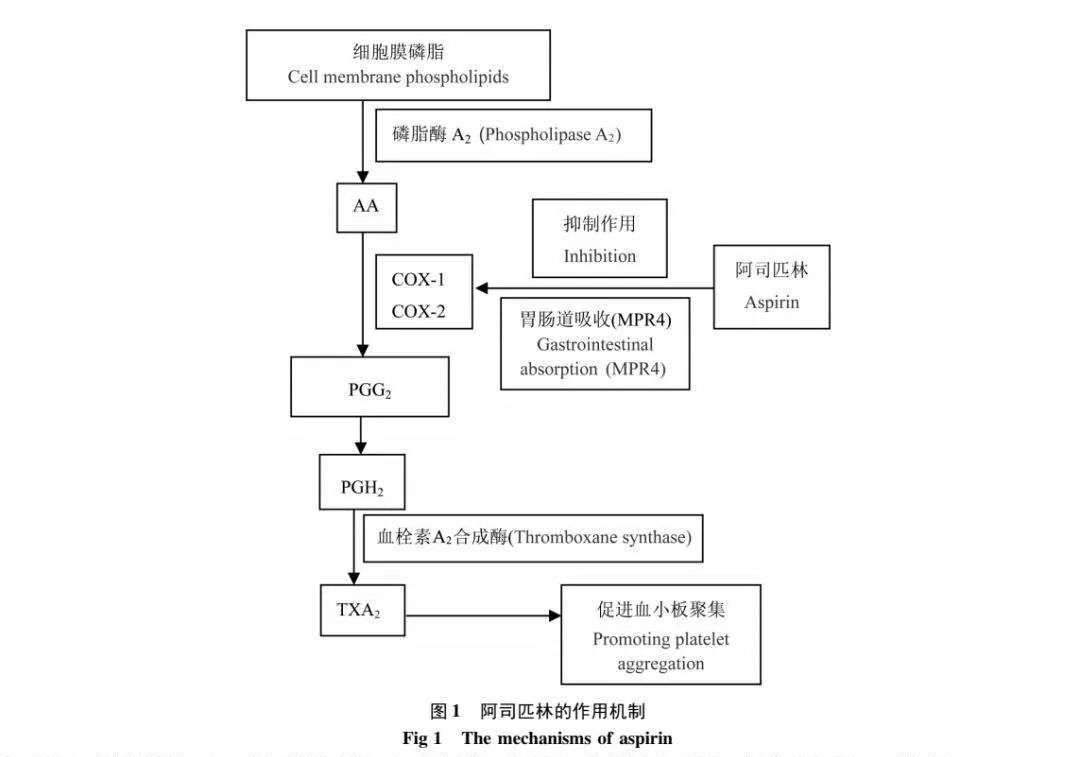
阿司匹林抗血小板作用机制图。PGG2:前列腺素G2,PGH2:前列腺素H2
阿司匹林并非对所有患者都有抗栓作用,部分患者不能从中获益,有研究报道称,5%~40%的人存在阿司匹林抵抗(AR)。
阿司匹林抵抗是指阿司匹林抑制血小板聚集功能低下,服用阿司匹林后仍出现心血管事件的现象。在我国复发性卒中及心脑血管疾病研究中,阿司匹林抵抗率、半抵抗率和敏感率分别为 20.4%,4.4%和75.2%。
什么造成了这种“抵抗”?
①临床因素:如患者的依从性、药物剂量、并发症、药物相互作用等;
②细胞因素:如血小板数目、药物代谢酶活性、mRNA表达等;
③生理因素:代谢性疾病,如:糖尿病、肥胖、高血脂症等,同型半胱氨酸,性别差异及吸烟、精神紧张、应激等引起去甲肾上腺素的释放增加的行为;
④遗传因素:如细胞色素 P450家族(CYP)、糖蛋白受体(GP)和环氧化酶(COX)等相关基因的多态性。
其中,遗传因素是药物反应个体差异的重要影响因素,抗血小板药物相关基因多态性的检测,可以为抗血小板药物的疗效和不良反应预测提供依据,指导临床合理用药。
检验人员根据基因型检测结果,综合分析,最终给出患者阿司匹林抵抗和抗凝效果的评价结果:不抵抗,抗血小板凝集效果好,或抵抗,抗血小板凝集效果差。
如果检测结果显示,阿司匹林较容易出现抵抗,抗血小板凝集效果较差,建议更换替代药物进行治疗或采用联合用药进行治疗;由于阿司匹林在心脑血管疾病中预防使用的普遍性,若无可替代药物,建议持续重点监测潜在阿司匹林抵抗风险个体的心脑血管疾病进展状况。
阿司匹林抵抗的内在机制是非常复杂的,基因多态性只是其中之一。而且与阿司匹林抵抗相关的基因多态性位点有许多,这些基因之间也相互影响。因此阿司匹林基因检测结果,只能给临床应用阿司匹林提供一个参考,具体用药策略的调整还需要临床医务人员对患者整体进行评估,个体化的指导患者用药。